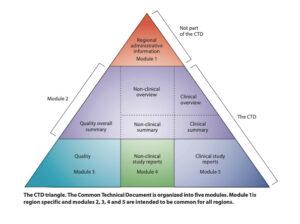
L’ottenimento dell’AIC è un processo che richiede una rigorosa applicazione delle normative di riferimento, in primis della Direttiva 2001/83/CE, e la presentazione della documentazione richiesta mediante la redazione dell’electronic Common Technical Document (eCTD).
Dopo aver individuato con il cliente la strategia regolatoria che permette di distinguere la tipologia di registrazione da seguire, ci occupiamo di:
- Allestimento dell’eCTD attraverso l’utilizzo di una piattaforma validata, seguendo le linee guida dell’International Council for Harmonization (ICH);
- Sottomissione alle autorità regolatorie e gestione dei rapporti istituzionali.
Inoltre, SCF fornisce i seguenti servizi:
- Redazione degli stampati (RCP, etichette e fogli illustrativi) in accordo alle linee guida vigenti;
- Supporto nelle registrazioni nazionali e comunitarie di medicinali (procedure nazionali, DCP, MRP e Centralizzate);
- Gestione delle variazioni e conversione di CTD in eCTD;
- Registrazione di broker e distributori dei medicinali presso il Ministero della Salute;
- Gestione pratiche inerenti le autorizzazioni per il commercio di sostanze stupefacenti e psicotrope presso il Ministero della Salute;
- Valutazione della conformità regolatoria del materiale di informazione medico-scientifica.
Inoltre, grazie alla partnership con la CRO UNIFARM, supportiamo il cliente anche nella conduzione di studi clinici registrativi, interventistici, osservazionali e studi di bioequivalenza, e di analisi quali-quantitative secondo le norme GLP (Good Laboratory Practice).
